Mobile Gesundheitsanwendungen verarbeiten sensible und besonders schützenswerte persönliche Daten. Das Bundesamt für Sicherheit in der Informationstechnik (BSI) hat dazu eine Technische Richtlinie (TR) entwickelt, die bei Anwendung den Zugriff Unbefugter auf diese Daten erschweren kann.
Die TR „Sicherheitsanforderungen an digitale Gesundheitsanwendungen“ (BSI TR-03161: https://www.bsi.bund.de/DE/Publikationen/TechnischeRichtlinien/tr03161/tr03161_node.html ) ist unabhängig von und bereits im Vorfeld der gegenwärtigen Corona-Pandemie für Gesundheits-Apps entwickelt worden. Sie kann grundsätzlich für alle mobilen Anwendungen, die sensible Daten verarbeiten und speichern, herangezogen werden. Grundsätzlich fordert das BSI, Sicherheitsanforderungen von Anfang an bei der Software-Entwicklung mitzudenken.
Dazu der Präsident des BSI, Arne Schönbohm:
„Sensible Gesundheitsdaten verdienen einen besonderen Schutz. Sowohl das jeweilige Smartphone der Nutzerinnen und Nutzer als auch die Hintergrundanwendungen auf Seiten der Anbieter müssen daher ein Mindestmaß an Sicherheit vorweisen können. Denn die Veröffentlichung solch sensibler Daten wie Pulsfrequenz, Schlafrhythmus oder Medikationspläne, lässt sich nicht ungeschehen machen. Hier kann nicht, wie im Falle eines Missbrauchs beim Online-Banking, der Fehlbetrag zurückgebucht werden. Mit der nun bereitgestellten Technischen Richtlinie stellt das BSI als die Cyber-Sicherheitsbehörde des Bundes einen wichtigen Leitfaden zur Verfügung, damit die Anwendungen das erforderliche IT-Sicherheitsniveau erreichen können.“
Die TR verfolgt die grundsätzlichen Schutzziele der IT-Sicherheit: Vertraulichkeit, Integrität und Verfügbarkeit. Sie kann als Mindestanforderung für den sicheren Betrieb einer Anwendung betrachtet werden. Die TR wird in einem „trial use“-Status veröffentlicht. In zukünftigen Versionen werden auf Grundlage der Erfahrungen und der Rückmeldungen aus der Industrie, Erweiterungen vorgenommen, die eine Zertifizierung von Apps nach dieser Technischen Richtlinie ermöglichen. Bereits jetzt kann die TR herangezogen werden, um – im Rahmen einer Selbsterklärung der Entwickler – den entsprechenden Anforderungen des Zulassungsverfahrens des Bundesinstituts für Arzneimittel und Medizinprodukte (BfArM) genüge zu tun.
Fachartikel
Studien

Drei Viertel aller DACH-Unternehmen haben jetzt CISOs – nur wird diese Rolle oft noch missverstanden

AI-Security-Report 2024 verdeutlicht: Deutsche Unternehmen sind mit Cybersecurity-Markt überfordert

Cloud-Transformation & GRC: Die Wolkendecke wird zur Superzelle

Threat Report: Anstieg der Ransomware-Vorfälle durch ERP-Kompromittierung um 400 %

Studie zu PKI und Post-Quanten-Kryptographie verdeutlicht wachsenden Bedarf an digitalem Vertrauen bei DACH-Organisationen
Whitepaper
Unter4Ohren

Datenklassifizierung: Sicherheit, Konformität und Kontrolle

Die Rolle der KI in der IT-Sicherheit
CrowdStrike Global Threat Report 2024 – Einblicke in die aktuelle Bedrohungslandschaft
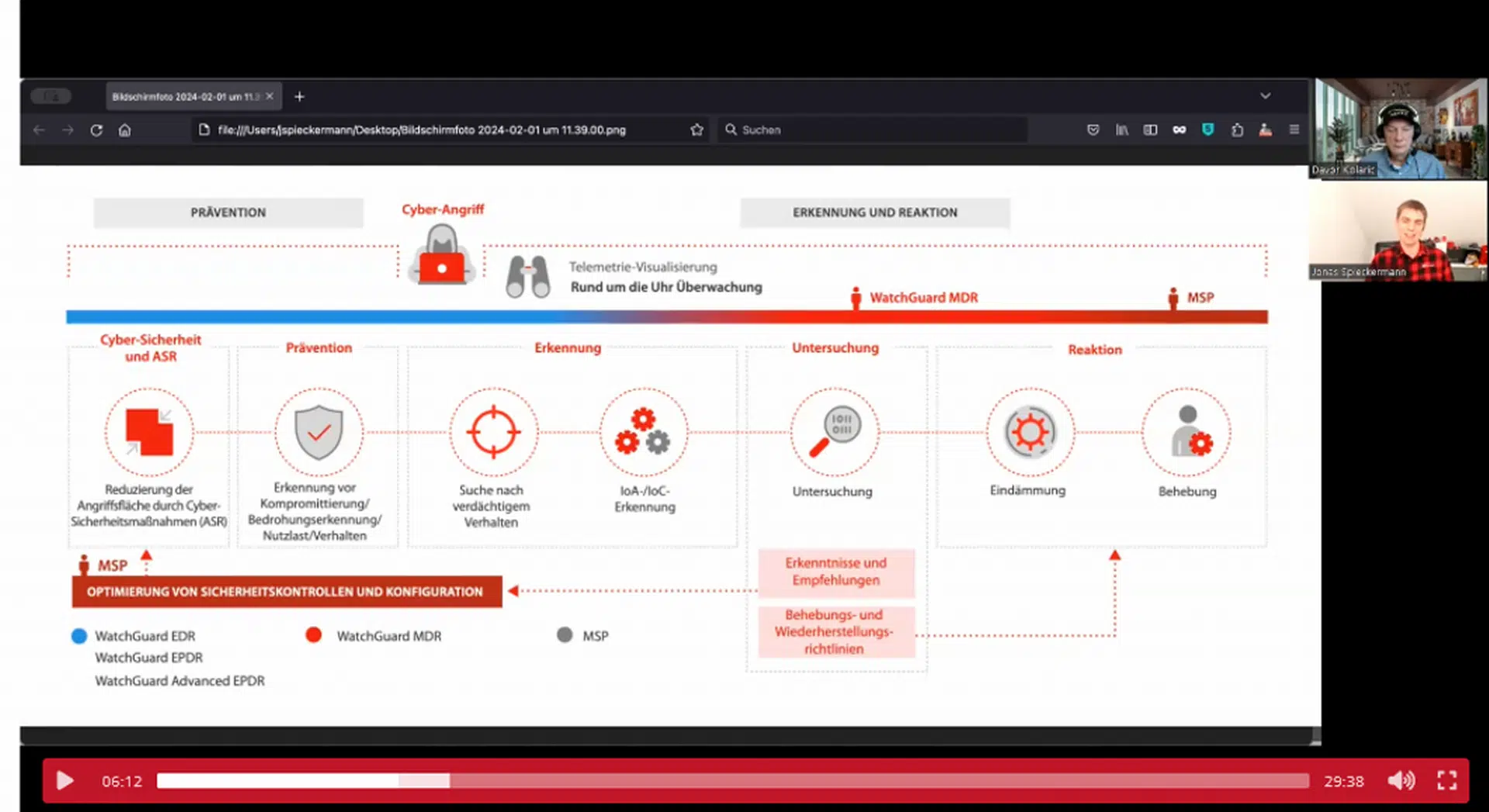
WatchGuard Managed Detection & Response – Erkennung und Reaktion rund um die Uhr ohne Mehraufwand